-
在线咨询

关注微信公众号

在肿瘤细胞功能实验中,常见的实验包括细胞增殖、迁移和侵袭等。本期重点学习【细胞克隆形成实验】,用于检测细胞的增殖能力。
01 实验原理
细胞克隆形成实验是一种重要的技术方法,用于评估细胞的增殖能力、侵袭性以及对杀伤因素的敏感性等。
当单个细胞在体外连续增殖达到6代以上时,其后代形成的细胞群体被称为集落或克隆。细胞克隆形成率即细胞接种存活率,是指接种细胞后贴壁的细胞成活并形成克隆的数量。贴壁后的细胞不一定每个都能增殖和形成克隆,而形成克隆的细胞必为贴壁和有增殖活动的细胞。
克隆形成率反映了细胞群体的依赖性和增殖能力这两个重要特征。

02 实验目的
1)通过对细胞处理后在细胞培养板上的克隆形成能力来提示处理后细胞的增殖能力;
2)评价不同杀伤因素,如药物或基因等对肿瘤细胞增殖能力或群体依赖性的敏感性;
3)评价在体内成瘤性,癌细胞不一定都可以在体内成瘤,但若体外克隆能力越强,即表明体内成瘤性越强,算是模拟体内成瘤的体外实验。
03 克隆形成实验分类与流程
克隆形成依据采用的培养介质不同,分为平板克隆和软琼脂克隆两类。
——平台克隆实验——
| 6孔板 |
| 细胞处理:将处于对数生长期的细胞用胰酶消化,并重悬成细胞悬液,然后进行计数; |
| 细胞接种:将确定数量的细胞接种到6孔板中的各实验组,每孔接种400-1,000个细胞; |
| 培养观察:继续培养细胞至14天或大多数克隆中的细胞数超过50个,每隔3天更换培养基并观察细胞状态; |
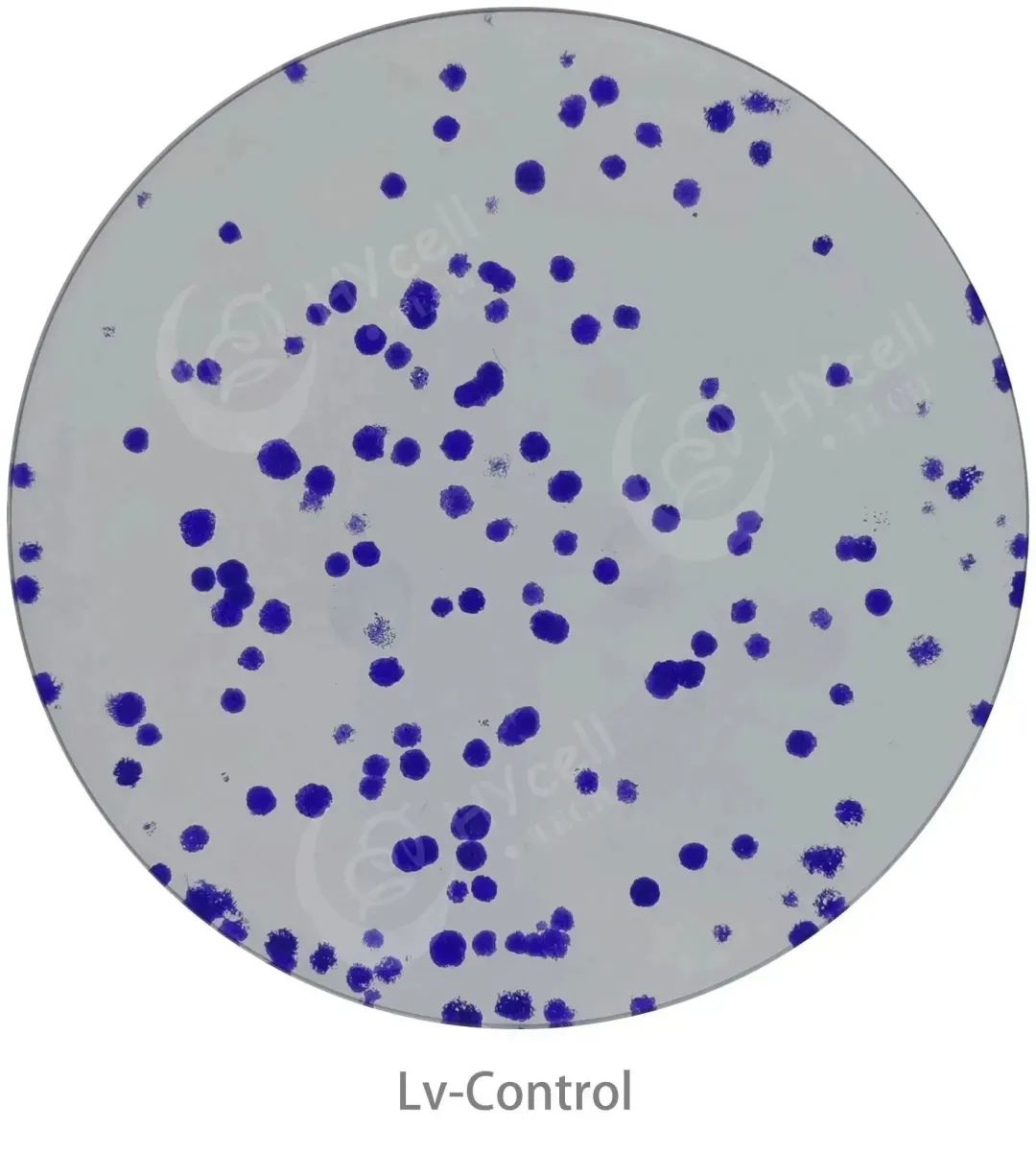
| 固定与染色:克隆完成后,拍照记录细胞形态,然后用PBS洗涤细胞,加入4%多聚甲醛固定细胞30-60分钟,再次洗涤; |
| 染色和拍照:加入结晶紫染液染色细胞10-20分钟,再次用PBS洗涤细胞,晾干后用数码相机进行拍照(整个板和每个孔分别拍照)。 |
| 平皿 |
| 细胞处理:取对数生长期的细胞,用0.25%胰蛋白酶消化并吹打成单个细胞,然后悬浮在完全培养基中备用; |
| 细胞接种:每组细胞悬液按照梯度倍数稀释,每组分别接种100个细胞到含有10ml 37℃预温培养液的皿中,轻轻转动确保细胞均匀分散; |
| 培养观察:将培养皿放置在37℃、5% CO2和饱和湿度的细胞培养箱中培养2-3周; |
| 克隆观察:当出现肉眼可见的克隆时,停止培养。用PBS小心洗涤细胞2次; |
| 固定和染色:加入适量的固定液固定细胞,然后用染色液染色; |
| 洗涤和干燥:用流水缓慢洗去染色液,使细胞干燥; |
| 克隆计数:在带网格的透明胶片上,用肉眼计数可见克隆,或在低倍显微镜下计数大于10个细胞的克隆数; |
| 统计与分析:计算克隆形成率,克隆形成率=(克隆数/接种细胞数)*100%。 |
——软琼脂克隆实验——
软琼脂克隆形成(Soft agar colony formation)又称为非锚定依赖性生长实验(Anchorage-independent assay),利用软琼脂作为培养介质,使细胞在悬浮状态下生长。在这种实验中,恶性肿瘤细胞具有贴壁生长和悬浮生长的能力,通过软琼脂中形成克隆的能力反映了其恶性程度,因此可以用于细胞分化的基础研究以及评估临床肿瘤治疗的疗效等方面。
| 配制1.2%和0.7%琼脂,高压灭菌; |
| 将1.2%琼脂与2×培养基混合,铺入6孔板底部,37°C孵育30分钟使其凝固; |
| 将单细胞悬液与0.7%琼脂混匀,加入6孔板作为上层胶,每孔1.5ml。加入培养基后,每3天更换一次; |
| 孵育2-3周后,使用显微镜观察克隆的大小,并拍照。如果拍摄整个孔,可在每孔加入200μl氯化硝基四氮唑蓝(NBT)染色,37°C过夜后拍照; |
| 统计与分析:计算克隆形成率,克隆形成率=(克隆数/接种细胞数)*100%。 |